水的电离
(1)电离平衡和电离程度
水是极弱的电解质,能微弱电离
H2O+H2O H3O++OH-,通常简写为H2O H++OH-;ΔH>0
25℃时,纯水中c(H+)=c(OH-)=1×10-7mol/L

(2)水的离子积
在一定温度时,c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积。
KW=c(H+)·c(OH-),25℃时,KW=1×10-14(无单位)。
①KW只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,KW增大。
25℃时KW=1×10-14,100℃时KW约为1×10-12。
②水的离子积不仅适用于纯水,也适用于其他稀溶液。不论是纯水还是稀酸、碱、盐溶液,只要温 度不变,KW就不变。

(3)影响水的电离平衡的因素
①温度
温度越高电离程度越大
c(H+)和c(OH-)同时增大,KW增大,但c(H+)和c(OH-)始终保持相等,仍显中性。
纯水由25℃升到100℃,c(H+)和c(OH-)从1×10-7mol/L增大到1×10-6mol/L(pH变为6)。

②酸、碱
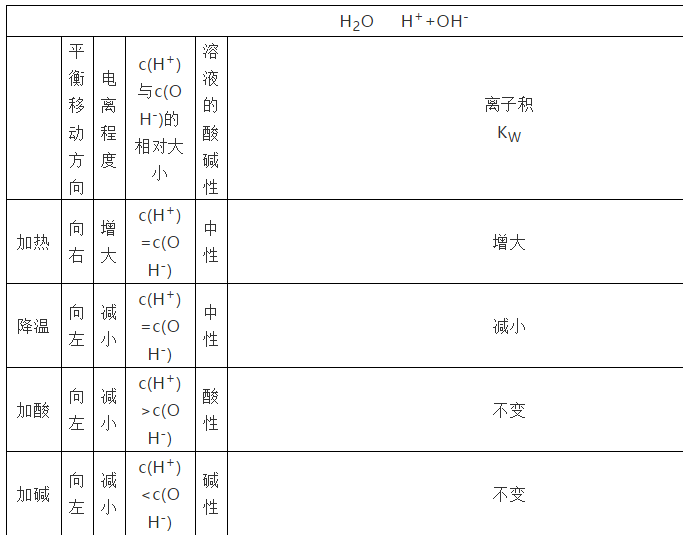
向纯水中加酸、碱平衡向左移动,水的电离程度变小,但KW不变。
③加入易水解的盐
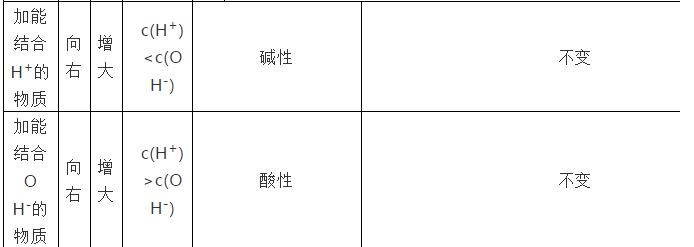
由于盐的离子结合H+或OH-而促进水的电离,使水的电离程度增大。温度不变时,KW不变。
练习:影响水的电离平衡的因素可归纳如下:
溶液的酸碱性
溶液的酸碱性取决于溶液中的c(H+)与c(OH-)的相对大小。
在常温下,中性溶液:c(H+)=c(OH-)=1×10-7mol/L;
酸性溶液:c(H+)>c(OH-), c(H+)>1×10-7mol/L;
碱性溶液:c(H+)<c(OH-),c(H+)<1×10-7‑mol/L。
思考:c(H+)>1×10-7mol/L(pH<7)的溶液是否一定成酸性?

溶液的pH
⑴表示方法
pH=-lgc(H+) c(H+)=10-pH
pOH=-lgc(OH-) c(OH-)=10-pOH
常温下,pH+pOH=-lgc(H+)-lgc(OH-)=-lgc(H+)·c(OH-)=14。
⑵溶液的酸碱性与pH的关系(常温时)
①中性溶液:c(H+)=c(OH-)=1×10‑7mol·L-1,pH=7。
②酸性溶液:c(H+)>1×10-7mol·L-1>c(OH-),pH<7,酸性越强,pH越小。
③碱性溶液:c(H+)<1×10-7mol·L-1>c(OH-),pH>7,碱性越强,pH越大。
思考:1、甲溶液的pH是乙溶液的2倍,则两者的c(H+)是什么关系?
2、pH<7的溶液是否一定成酸性?(注意:pH=0的溶液c(H+)=1mol/L。)
⑶pH的适用范围
c(H+)的大小范围为:1.0×10-14mol·L-1<c(H+)<1mol·L-1。即pH 范围通常是0~14。
当c(H+)≥1mol·L-1或c(OH-)≥1mol·L-1时,用物质的量浓度直接表示更方便。
⑷溶液pH的测定方法
①酸碱指示剂法:
只能测出pH的范围,一般不能准确测定pH。

②pH试纸法:
粗略测定溶液的pH。
pH试纸的使用方法:取一小块pH试纸放在玻璃片(或表面皿)上,用洁净的玻璃棒蘸取待测液滴在试纸的中部,随即(30s内)与标准比色卡比色对照,确定溶液的pH。
测定溶液pH时,pH试剂不能用蒸馏水润湿(否则相当于将溶液稀释,使非中性溶液的pH测定产生误差);不能将pH试纸伸入待测试液中,以免污染试剂。
标准比色卡的颜色按pH从小到大依次是:红 (酸性),蓝 (碱性)。
③pH计法:精确测定溶液pH。
4、有关pH的计算
基本原则:
一看常温,二看强弱(无强无弱,无法判断),三看浓度(pH or c)
酸性先算c(H+),碱性先算c(OH—)
⑴单一溶液的pH计算
①由强酸强碱浓度求pH
②已知pH求强酸强碱浓度
⑵加水稀释计算
①强酸pH=a,加水稀释10n倍,则pH=a+n。
②弱酸pH=a,加水稀释10n倍,则pH<a+n。
③强碱pH=b,加水稀释10n倍,则pH=b-n。
④弱碱pH=b,加水稀释10n倍,则pH>b-n。
⑤酸、碱溶液无限稀释时,pH只能约等于或接近于7,酸的pH不能大于7,碱的pH不能小于7。
⑥对于浓度(或pH)相同的强酸和弱酸,稀释相同倍数,强酸的pH变化幅度大。
⑶酸碱混合计算
①两种强酸混合
c(H+)混=
②两种强碱混合
c(OH-)混=
③酸碱混合,一者过量时
c(OH-)混或c(H+)混=
若酸过量,则求出c(H+),再得出pH;若碱适量,则先求c(OH-),再由KW得出c(H+),进而求得pH,或由c(OH-)得出pOH再得pH。
溶液酸碱性pH计算经验规律
(1)两强酸等体积混合 混合后的pH=小的+0.3
(2)两强碱等体积混合 混合后的pH=大的—0.3
(3)当按所给反应物质的量之比计算时,酸碱不论强弱,谁大谁过剩,溶液呈谁性。
(5)pH 减小一个单位,[H+]扩大为原来的10倍。PH增大2个单位,[H+]减为原来的1/100
(6)稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的 1/m , 强酸中c(H+)变为原来的1/m ,但弱酸中c(H+)减小小于m倍,故稀释后弱酸酸性强于强酸。

酸碱中和滴定
主要仪器
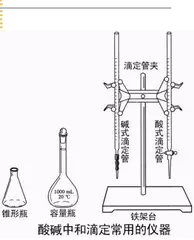
(1)滴定管
滴定管分为________滴定管和________滴定管。酸性溶液装在________滴定管中,碱性溶液装在________滴定管中。如图所示:
(2)锥形瓶、烧杯、铁架台、滴定管夹等。
2.主要试剂
标准液、待测液、_指示剂_、蒸馏水。
3.实验操作(用标准盐酸滴定待测NaOH溶液)
1.准备:①洗涤 ②查漏 ③润洗 ④装液体 ⑤排气泡 ⑥调整液面 ⑦读数
2.滴定:①量取待测液并加指示剂 ②滴定至终点并读数
③重复操作三次 ④计算

【注意】

①滴定时在瓶底垫一张白纸;
②滴定时左手控制旋钮、右手振荡锥形瓶、目光注视锥形瓶内溶液颜色变化。
③锥形瓶:只用蒸馏水洗涤,不能用待测液润洗
④先快后慢,当接近终点时,应一滴一摇
⑤注入标准液至“0”刻度上方2~3cm处,将液面调节到“0”刻度(或“0”刻度以下某一刻度)
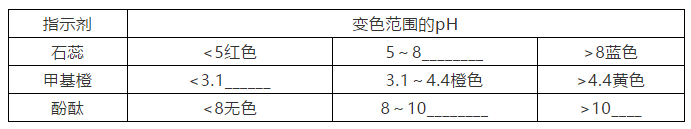
注意:指示剂的选择:变色灵敏、明显。一般用酚酞,不用石蕊
4.常用酸碱指示剂及变色范围
5.滴定终点判断
当最后一滴刚好使指示剂颜色发生明显的改变而且半分钟内不恢复原来的颜色,即为滴定终点。

问题思考

(1)KMnO4(H+)溶液、溴水、Na2CO3溶液、稀盐酸应分别盛放在哪种滴定管中?
(2)滴定终点就是酸碱恰好中和的点吗?
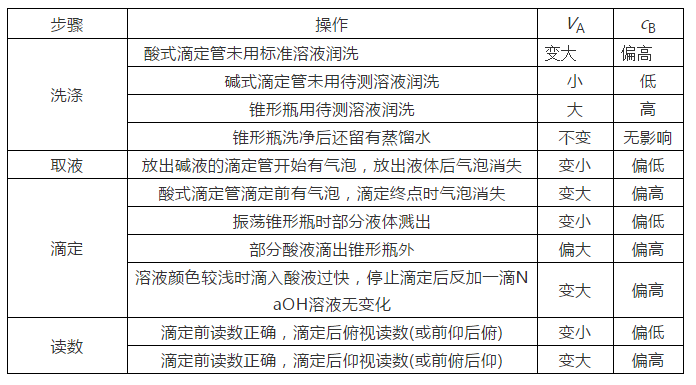
6.酸碱中和滴定的误差分析

原理

(以标准盐酸滴定待测NaOH溶液为例)
cB=
VB——准确量取的待测液的体积;
cA——标准溶液的浓度。
c(待)的大小取决于V(标)的大小,V(标)大,则c(待)大,V(标)小,则c(待)小。

常见误差

以标准酸溶液滴定未知浓度的碱(酚酞作指示剂)为例,常见的因操作不正确而引起的误差有:
相关文章:
误入繁花深处许春惜秦远洲小说 误入繁花深处小说章节09-16
顾云琛陆熙全文试读 十五月小说全本无弹窗 顾云琛陆熙小说全文在线阅读09-16
樱花落尽阶前月阮闻樱傅景明大结局在线阅读09-15
别暗恋了!我们光明正大结婚吧小说最后结局,梅梓清伊德百度贴吧小说全文免费09-15
九都保险柜24小时服务热线是多少?如何联系?(九都保险柜电子保险柜怎么解锁)09-15
